ایمنوپاتوبیلوژی کرونا:
تعدادی از این بیماران ممکن است دچار ARDS و نارسایی چند ارگانی شوند. در حال حاضر داروهای مورد استفاده در کرونا شامل دگزامتازون – رمدسویر و ضد انعقاد هاست در بیمارانی که بیماری شدیدی دارند همراه هستند با لنفوپنی افزایش CRP و دیدایمر افزایش دی دایمر افزایش فرتین و LDH . بیمارانی که احتمال بیماری شدید دارند شامل افراد پیر افراد مرد بیماران با بیماری قلبی دیابت چاقی بیماری تنفسی مزمن و بیمارانی که نقص ایمنی دارند در حالی که یک پاسخ ایمنی منظم در کنترل این بیماری مهم است اما یک پاسخ ایمنی شدید همراه با پاسخ ایمنی ادپتیو غیر کافی باعث تخریب بافت ها می شود. همچنین این بیماری می تواند موجب نارهنجاری های اتوایمون و التهاب های شدید شود در حال حاضر داروی قطعی برای این بیماری وجود ندارد و پیشگیری و واکسن فعلا اولویت اولیه است.
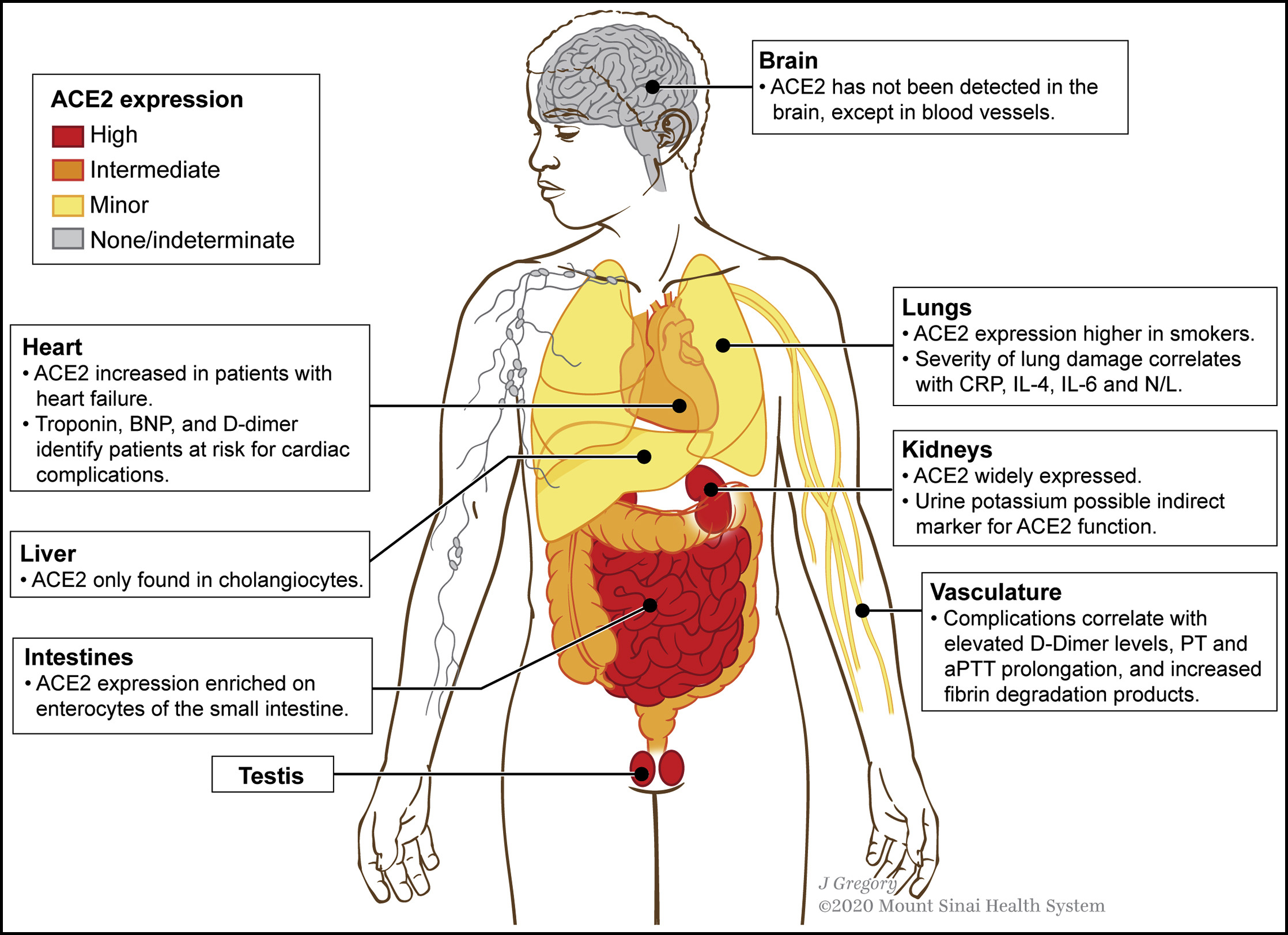
بیماری ناشی از
1) اثر مخرب خود ویروس
2) به هم خوردن سیستم آنژیوتنسین کانورتینگ انزایم 2 که موجب می شود که سیستم رنین آنژیوتنسین آلدسترون بهم بخورد و باعث کاهش غیر فعال شدن برادی کاینین شود.
3) طوفان سایتوکاینی
4) ایجاد لخته
5) اتوایمنیوتی
پاسخ ایمنی ذاتی: ایمنی ذاتی اولین دفاع بدن بر علیه ویروس است. ویروس با وجود پروتئین S,B گیرنده ACE2 متصل می شود. و اولین مکانیزمی که ویروس وارد سلول می شود توسط مکانیزمی به نام اندوسایتوزیز می باشد. دومین مکانیزم ورود به سلول توسط یک پروتئاز داخل غشایی به نام TMPRS2 اتفاق می افتد. با ورود ویروس به داخل سلول رسپتورهای داخل سلولی به نام PRR مثل TLR فعال می شوند و این ها باعث فعال شدن فاکتورهای ترجمه ای مانند NFKAPPAB و فاکتورهای تنظیم کننده اینترفرون می شوند. پاسخ ناکافی اینترفرون باعث می شود که ویروس بتواند تکثیر پیدا کند پروتئین های متعددی در این ویروس وجود دارد که موجب می شود نوع 1 اینترفرون تولید نشود. این باعث می شود که ویروس تولید زیاد از حدی داشته باشد و در نهایت موجب افزایش تایپ 1 اینترفرون می شود که می تواند موجب افزایش التهاب در بیماران شدید بکند. به عنوان مثال در سلول های تنفسی نشان داده شده که میزان ترشح اینترفرون ناکافی بوده است در حالی که سایتوکاین هایی که التهاب شدید ایجاد می کنند به شدت افزایش پیدا کردند.این باعث می شود که در ریه این بیماران افزایش قابل توجهی از منوسید نوتروفیل ماکروفاژ و لوکوسیت داشته باشد. مثلا در بیمارانی که ژنهای TLR7 متفاوت شده اند جهش پیدا کرده اند همراه هستند با پاسخ ناکافی تیپ 1 و 2 اینترفرون. این مسئله شاید بتواند نتایج ناامید کننده آنتاگونیست های TLR7 مثل هیدرکسی کلروکین را توضیح بدهد در حالی که آرگونیست های TLR7 ممکن است درمان در برخی از بیماران موثر باشند. در مطالعه ای تقریبا در 10 درصد از بیماران با بیماری شدید اتو آنتی بادی بر علیه اینترفرون تایپ 1 داشته اند و بیشتر هم مردها بوده اند این مسئله می تواند پایه ای باشد برای درمان اینترفرونی در مراحل اول بیماری وقتی که علائم بیماری ملایم است. هر چند افزایش زیاد سایتوکاین ها در بیماری شدید مطرح می باشد اما اخیرا این مسئله کمی زیر سوال رفته است.
یکی دیگر از پاسخ های ذاتی کمپل مانت ها هستندکه در این بیماری فعالیت بسیار شدیدی پیدا می کند و موجب تخریب بافت ها می شوند این خود دلیلی شده است که داروهای مهار کننده کامپلومانت ها امروزه در درمان بیماری مطرح بشود
درنهایت مسئله دفاع ایمنی ذاتی و ارتباطش با لخته می باشد. در این بیماران به علت فعال شدن منوسیدها که در نهایت منجر به افزایش فاکتورهای بافتی شده است باعث می شود که روند انعقاد در این بیماران شروع شود. همچنین نوتروفیل ها که دام های خارج سلولی به نام NET ایجاد می کنند و این ها شامل DNA و هیستون هستند می توانند روند انعقاد را شروع بکنند. که این توسط فعال شدن فاکتور 8 و یا اتصال فاکتور بافتی TF به راه انعقادی خارجی ایجاد می شود.
پاسخ ایمنی تطبیقی
این سیستم نقش مهمی در نابودی ویروس ها توسط سلول های تی سایتوتوکسیک و یا از طریق تولید آنتی بادی های ضد ویروس توسط بی سل ها دارد. یکی از شاخصه های بیماری کاهش لنفوسیت هاست. که هم در CD4.8, تی سل ها و همچنین بی سل ها دیده می شود. کاهش لنفوسیت ها می تواند به علت کاهش اینتر فرون نوع 1 باشد که جزئی از ایمنی ذاتی است. دلیل دیگر آن می تواند به علت سایتوکاین هایی باشد که موجب از بین رفتن لنفوسیت ها باشد همچنین کاهش عملکرد ارگان های لنفاتیک و ارتشاح وسیع لنفوسیت ها در ارگان ها شامل ریه دلیل دیگر آن است. از دست رفتن مراکز زایشی در تهال و لنفسیت ها باعث ایمنی همرال ناکافی شده که در برخی از بیماران که دومرتبه بیماری را گرفتند دیده می شود.در عین حال در اکثر بیماران خفیف تا متوسط وجود یک پاسخ ایمنی قوی شامل آنتی بادی ها بر علیه پروتئین S و آنتی ژن های مشتق شده از نوکلئوپروتئین ها و پروتئین های قشای سلولی و آنتی بادی های خنثی کننده شامل آنتی بادی های ضد پروتئین S که می تواند برای ماه ها بعد از عفونت اولیه انجام شود دیده می شود. در هر حال وجود یک سیستم ایمنی انطباقی خوب باعث یک بیماری خفیف می شود که در نهایت با یک بیماری ویروسی کنترل شده پایان می پذیرد.
اتوایمینیوتی:
همانطور که در بالا توضیح داده شد اشکالات در گیرنده های TLR در به وجود آمدن بیماری نقش دارند. TLR7 – RNA ویروس را تشخیص می دهد و باعث شروع یک پاسخ ایمنی می شود.اما همین TLR می تواند RNA خودی را تشخیص دهد و مانع خود ایمنی شود.یک بیماری به نام سندروم التهابی مولتی سیستمیک در بچه ها شناخته شده است که بسیار شبیه به بیماری کابازاکی می باشد. این بیماری به علت تشکیل اتو آنتی بادی های بعد از عفونت ایجاد می شود. اتو انتی بادی هایی که در بیماران کرونا مشاهده شده است شامل سندروم گلاندباره ITP سندروم آنتی فسفولوپید و TTP می باشد. سندروم آنتی فسفولوپید شدید در بیماران شدید کرونایی دیده می شود که همراه است با افزایش انعقاد پذیری . آنتی فسفولوپیدها باعث فعال شدن NF-GABABI و تی ال آر7 شده که باعث تولید زیاد سایتوکاین ها می شود. سلول های B خارج فلولیکولی همراه است با بیماری های خودایمنی مثل لوپوس که نشان می دهد آنتی بادی ها در ایجاد بیماری های اتوایمون نقش دارد.وجود IGM اتو آنتی بادی بر علیه ACE2 همراه است با شدت بیماری. وجود این آنتی بادی ها ممکن است در علائم طولانی در کووید های طولانی نقش داشته باشند.
مسئله دیگر کاهش عملکرد ایمنی در ارتباط با سن است که به نام ایمونوسنسنس گفته می شود که هم در ایمنی ذاتی و هم انطباقی دیده می شود. مسئله دیگر وابسته به سن یک التهاب سیستمیک پایین در افراد مسن است که به نام INFLAMMAGING که باعث می شود بیماران مسن بیمارای شدیدتری را تجربه کنند. در مردها این مسئله بیشتر دیده می شود. مردها پاسخ ذاتی شدیدی نشان می دهند که باعث افزایش سایتوکاین های خون می شود در حالی که خانم ها بیشتر فعالیت خوب تی سل را نشان می دهند. پاسخ بد تی سل در ارتباط با شدت بیماری در مردها وجود دارد.
مسئله دیگری چاقی است. در بیماران چاق میزان لپتین سرم بیشتر دیده می شود.که باعث افزایش التهاب بدن می شود. بنابراین درمان با رسوراترول ممکن است با توجه به مهار ترشح لپتین مفید باشد.
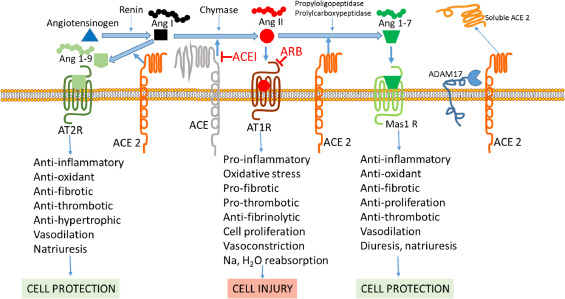
افزایش رسپتور های ACE2 ممکن است باعث شود که ویروس راحت تر وارد سلول بشود. اما مهار این ACE2 باعث کاهش غیرفعال شدن برادیکاینین می شود. و آنژیوادم ریوی ایجاد می شود به علاوه نامنظمی در سیستم RAAS توسط کاهش تبدیل آنژیوتانسین 2 به آنژیوتانسین یک تا هفت می شود. آنژیوتانسن 2 MMP 17 را فعال می کند و باعث ترشح سایتوکاینین ها می شود. بیماران مسن مردها و /ادم های چاق میزان ACE2 داخل سرم بیشتری دارند. این باعث می شود که این ACE2 به ویروس وصل شود و ایجاد واکنش ایمنی بکند. برعکس ACE2 داخل سرمی ممکن است سودمند باشد چرا که به ویروس می چسبد و باعث می شود که ویروس به رسپتور قشایی سلول نچسبد.
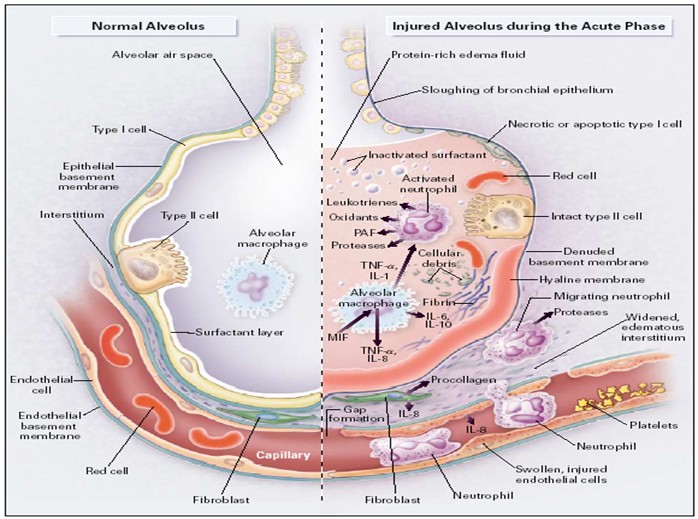
سیستم تنفسی : ابتدا یک بیماری شبیه به آنفولانزا ایجاد می شود و به دنبال آن یک پاسخ ایمنی زیاد باعث ARDS می شود مطالعه پاتولوژیک نشان دهنده DAD و ارتشاح سلول های T می باشد.حتی در بیماران شدیدتر یک فرم شدیدی از DAD دیده می شود به نام پونومونی ارگانایزینگ با فیبرینوئید شدید. شکل معمول DAD همراه است با تشکیل غشا هیالین افزایش سلول های نوع دوم پونوموسیتی.اگرچه ویروس های بسیاری در مراحل اولیه بیماری در بافت ریه دیده می شود اما در مراحل دیرتر ویروس های بسیار کمی دیده می شود علت این موضوع این هست که ایمنی بدن ویروس ها را از بین بردند و در حال از بین بردن بافت ریوی است. یک گروه از بیماران در مراحل اولیه میمیرند که در پاتوبیلوژی ریه مقادیر زیادی ویروس وجود دارد اینها معمولا فاکتورهای کشنده غیر ریوی دارندگروه دوم بیماران گروهی هستند که DAD تشکیل می دهند که علت مرگ اینها در واقع ایمنی نادرست است. یکی از شاخصه های دیگر درگیری ریوی بیماران کرونا وجود لخته های ریز می باشد. در پاتولوژی این بیماران تجمع نوتروفیل ها در پارانشیم ریه و عروق ریه دیده می شود که تشکیل NET کرده اند و باعث ایجاد لخته ریوی کرده اند.
در کسانی که دچار پونومونی کرونایی می شوند ممکن است بین 15 تا 40 درصد ARDS را بگیرند تقریبا 80 درصد از بیماران شدید اکسیژن نیاز دارند که از این میان 30 تا 40 درصدشان به تهویه مکانیکی نیاز دارند کسانی که تهویه مکانیکی نیاز دارند در نهایت بین 70 تا 90 درصد میمیرند.
در پاتولوژی بیماران مبتلا به کووید ریوی شاهد درد DAD همراه با لخته های کوچک حاوی پلاکت و فیبرین هستیم. در کسانی که ARDS کرونایی بگیرند ظرفیت ریه نسبت به ARDS سایر بیماری ها بالا می ماند. در پاتولوژی این بیماران مایع غلیظ در داخل آلوئول و بافت بینابینی همراه با تجمع خون و گشاد شدن راه های آلوئولی و کلپس آلوئول ها همراه با تشکیل غشا هیالینی و داسکوآماسیون پنوموسیدها . بررسی با میکروسکوپ الکترونیک نشان دهنده ذرات ویروس در سلول های ریوی نوع یک و دو می باشد.
همچنین لخته های خونی در عروق شریان ریوی با سایز کوچک و متوسط دیده می شود افزایش مگا کاریوسد ها ( سی دی 61 +) در عروق آلوئولی در لخته های کوچک دیده می شود. لخته های کوچک در ارگان های بزرگ مثل ریه قلب مغز کبد دیده می شوند و متناسب با وجود رسپتورهای ACE2 آندوتلیالی هستند. این لخته های کوچک منجر به نقص عملکرد این ارگان ها شده و باعث افزایش مرگ و میر در این ارگان ها می شود. در یک مطالعه نشان داده شد که لخنه های ریز در مویرگ های آلوئولی 9 برابر در بیماران کرونایی نسبت به آنفولانزای آ بیشتر دیده می شود. همچنین در بیماران کرونایی ما شاهد افزایش سلول های آندوتلیالی ACE2+ هستیم که موجب از بین رفتن اتصال بین سلولی شده و تورم سلولی و از بین رفتن سلول ها از غشا پایه ای می شود. مطالعات نشان می دهد که خود ویروس موجب التهاب آندوتلیال می شود و موجب تخریب آنها می گردد.
در همه مطالعات تا الان نشان داده شده است که ارتشاح التهابی سلول های منونوکلئار در پارانشیم ریه متشکل از لنفوسیت ها و ماکروفاژها هستند. هم CD4 و هم CD8 تی سل ها در اطراف برونشیول ها و آلبئول ها وجود دارند گرچه بیشتر CD4 ها غالب هستند. CD4 ها اطراف عروق ریز تجمع پیدا می کنند که غالبا شامل لخته های کوچک هستند. ماکروفاژهای CD68 و همچنین سلول های چند هسته ای بیشتر در لومن های آلوئولی هستند. وجود ماکروفاژها تناسبی دارد با شدت بیماری
مطالعه جدیدی نشان داده که افزایش CRP فرتین اینترلوکین 6 – 8 و تی ان اف آلفا همراه هستند با وجود ماکروفاژهایی که خصوصیت فاگوسایتوزیز دارند در بافت های لنفی
طوفان سایتوکاینی: دو مطالعه بزرگ در چین در مورد پیش آگهی این بیماران انجام شده است در این مطالعات نشان داده شده که افزایش CRP – LDH فرتین و IL6 همراه است با افزایش مرگ و میر. همچنین افزایش ARDS در این بیماران با این خصوصیات بیشتر دیده می شود. بیماران کرونایی افزایش IL1β اینترلوکین 1 Rα اینترلوکین 7 اینترلوکین 8 و IL10 و FGF و G-CSFIFNɣ و CXCL10 و MCP1 (CCL2 ) و MIP1α/CCL3 و MIPβ/CCL4 و PDGF و TNFα و VEGF بالایی دارند. این سایتوکاین ها در بیمارانی که در آِ سی یو بستری هستند بالاترند. در بیمارستانی در نیویورک سطح IL6 – IL8 – TNFα در بیماران شدید کرونایی بالاتر بود. IL6 و TNFα در بدو بیمارستانی شدن متناسب است با شدت بیماری و احتمال مرگ و میر. قبل از مرگ در این بیماران یک افزایش زیادی در اینترلوکین 6 – 8 و TNFα دیده می شود. افزایش اینترلوکین 1 بتا از سلول ها موجب ایجاد تب می شود و میزان آن در سرم بیماران شدید و مایع لاواژی افزایش پیدا می کند. PAMP همانند RNA ویروسی از سلول های اپیتلیال غفونی شده رها می شود. یک رشته از رسپتورها به نام PRR این PAMP ها را پیدا می کند. و به همراه IL/1R باعث فعالیت و ترشح سایتوکاین های ذکر شده در بالا می شود. این سایتوکاین ها به نوبه خود باعث تجمع ماکروفاژها و تی سل ها در محل عفونت می شوند. که در نهایت موجب تخریب پارانشیم ریه می شود. پاسخ اصلی ایمنی در کرونا TH1 و M1 می باشد.
| Biomarker | Purpose | |
|---|---|---|
| Routine Bloodwork | Lymphocyte count | Predicted the disease severity and the outcomes of hospitalized patients (Tan et al., 2020a). Prognostic value was confirmed in numerous studies (Huang et al., 2020d, Liu et al., 2020b, Song et al., 2020, Wang et al., 2020f, Wynants et al., 2020, Yan et al., 2020b, Yang et al., 2020b, Zhang et al., 2020c, Zhao et al., 2020d). Decreased continuously in non-surviving patients (Wang et al., 2020b). |
| N/L | Patients with N/L ≥3.13 were reported to be more likely to develop severe illness and to require ICU admission (Liu et al., 2020c). N/L on admission was a risk factor for short-term progression of patients with moderate pneumonia to severe pneumonia (Feng et al., 2020). Confirmed to be of prognostic value in COVID-19 in several studies (Song et al., 2020, Wynants et al., 2020, Zhou et al., 2020d). |
|
| CRP | Proposed as an early biomarker of disease progression (Ji et al., 2020). Even in early stages, CRP levels were positively correlated with lung lesions and reflected disease severity (Wang, 2020). Confirmed in numerous studies (Fu et al., 2020, Huang et al., 2020d, Wynants et al., 2020, Yan et al., 2020b, Zhao et al., 2020d, Zhou et al., 2020b). Predicted the risk of acute myocardial injury (Liu et al., 2020g, Xu et al., 2020a). | |
| LDH | Higher in severe cases than in mild cases (Xiang et al., 2020a). Widely proposed to have prognostic value in COVID-19 (Huang et al., 2020d, Wynants et al., 2020, Yan et al., 2020b, Zhao et al., 2020d). | |
| D-dimer (and coagulation parameters) | Predicted severity independently of other variables (Zhou et al., 2020d). Elevated levels and disseminated intravascular coagulation are found in non-survivors (Wang et al., 2020b). Identified patients at risk for acute cardiac injury (Liu et al., 2020g). Other coagulation parameters, such as fibrin degradation product levels, longer prothrombin time, and activated partial thromboplastin time, were also associated with poor prognosis (Tang et al., 2020a). | |
| SAA | SAA was proposed to be used as an auxiliary index for diagnosis as it was elevated in 80% of the patients in a small cohort (Ji et al., 2020). | |
| NT-proBNP (N-terminal pro B type natriuretic peptide) | NT-proBNP was an independent risk factor of in-hospital death in patients with severe COVID-19 (Gao et al., 2020b). | |
| Platelet count | High platelet-to-lymphocyte ratio was associated with worse outcome (Qu et al., 2020). Thrombocytopenia was associated with poor outcome and with incidence of myocardial injury in COVID-19 (Liu et al., 2020h, Shi et al., 2020). | |
| Immunological | CD4+, CD8+, and NK cell counts | Lower CD4+, CD8+, and NK cells in PBMCs correlated with severity of COVID-19 (Nie et al., 2020b). Validated by several studies (Wang et al., 2020f, Zheng et al., 2020b). |
| PD-1 and Tim-3 expression on T cells | Increasing PD-1 and Tim-3 expression on T cells could be detected as patients progressed from prodromal to overtly symptomatic stages (Diao et al., 2020). Expression was higher in infected patients versus healthy controls and in ICU versus non-ICU patients in both CD4 and CD8 T cells (Zhou et al., 2020b). | |
| phenotypic changes in peripheral blood monocytes | The presence of a distinct population of monocytes with high forward scatter (CD11b+, CD14+, CD16+, CD68+, CD80+, CD163+, and CD206+, which secrete IL-6, IL-10, and TNF-α) was identified in patients requiring prolonged hospitalization and ICU admission (Zhang et al., 2020c). CD14+CD16+IL-6+ monocytes are increased in ICU patients (Zhou et al., 2020b). | |
| IP-10, MCP-3, and IL-1ra | IP-10, MCP-3, and IL-1ra were, among 48 examined cytokines, the only ones that closely associated with disease severity and outcome of COVID-19 in a study by Yang et al. (Yang et al., 2020b). | |
| IL-6 | Associated with disease severity (hospitalization and ICU admission) and poor prognosis (Chen et al., 2020g, Huang et al., 2020b, Liu et al., 2020b, Liu et al., 2020f, Wang et al., 2020b). Increased levels were associated with higher risk of respiratory failure (Yao et al., 2020b). | |
| IL-8 | Positively correlated with disease severity (Chen et al., 2020e, Gong et al., 2020), with severe cases showing the highest IL-8 levels. | |
| IL-10 | Increased in severe or critical patients as compared to mild patients (Gong et al., 2020, Zhou et al., 2020d) without a statistically significant difference between severe and critical cases (Gong et al., 2020). | |
| IL-2R | Associated with disease severity in a study that, among other cytokines, also associated ferroprotein levels, PCT levels, and eosinophil counts with COVID-19 severity (Gong et al., 2020). | |
| IL-1β | CD14+IL-1β+ monocytes are abundant in early-recovery patients as shown in a single-cell RNA-seq analysis and thought to be associated with cytokine storm (Wen et al., 2020). IL-1β did not correlate with disease severity in a cross-sectional study with mild, severe, and critical patients (Gong et al., 2020). | |
| IL-4 | IL-4 was associated with impaired lung lesions (Fu et al., 2020), but some reports point to a potential mediator effect (Wen et al., 2020). | |
| IL-18 | In modeling immune cell interaction between DCs and B cells in late recovery COVID-19 patients, IL-18 was found to be important in B cell production of antibodies, which suggests its importance in recovery (Wen et al., 2020). | |
| GM-CSF | GM-CSF+IFN-γ+ T cells are higher in ICU than in non-ICU patients. CD14+CD16+GM-CSF+ monocytes are higher in COVID-19 patients as compared to healthy controls (Zhou et al., 2020b). | |
| IL-2 and IFN-γ | IL-2 and IFN-γ levels were shown to be increased in severe cases (Liu et al., 2020b). | |
| anti-SARS-CoV-2 antibody levels | Prolonged SARS-CoV-2 IgM positivity could be utilized as a predictive factor for poor recovery (Fu et al., 2020). Higher anti-SARS-CoV-2 IgG levels and higher N/L were more commonly found in severe cases (Zhang et al., 2020a). |
از طرف دیگر تکثیر ویروس در سلول های ریوی تایپ 2 ممکن است در ایجاد طوفان سایتوکاینی نقش داشته باشد. ابتدا ویروس ها سلول های نوع دوم را هدف می گیرند و این باعث کاهش تولید سورفاکتانت و تعمیر آلوئولی می شود. همچنین سلول های تایپ 2 در پاسخ ایمنی ذاتی نقش اختصاصی دارند سلول های ریوی تایپ 2 رسپتور هایی به نام TLR دارند که در نهایت باعث تحریک NF-KABABI می شود و پاسخ ایمنی در واکنش به ویروس ایجاد می شود سایتوکاین های ایجاد شده باعث ایجاد تحریک التهابی در ماکروفاژهای داخل ریه می شود و همچنین باعث کشاندن سلول های تی فعال شده به ریه می شود در نهایت اینترلوکین 6 در سلول های نوع دوم که با ویروس عفونت پیدا کرده اند ترشح می شود. همچنین این سلول ها سایتوکاین های دیگری مثل MCP1/CL2 و TNFα و اینترلوکین 1 بتا و اینترلوکین 6 تولید می کند.
سیگنال های تخریب شده اینترفرون ها هم در این بیماری نقش دارند ویروس کرونا می تواند ترشح اینترلوکین را در سلول های عفونی مختل کند. ویروس کرونا به درمان اینترفرون نوع یک و سه حساس هست. در بیماران شدید میزان اینترفرون نوع 1 نسبت به بیماران متوسط یا خفیف دچار اختلال شده است. و مطالعات نشان می دهد که اینتر فرون نوع 1 با سایتوکاین های مثل اینترلوکین 6 و TNFα رابطه معکوس دارد به اضافه اینکه مطالعات نشان می دهد که تزریق اینترفرون آلفا 2 بی در مراحل اولیه بیماری میزان مرگ و میر بیمارستانی را کاهش می دهد.
فعالیت های مختل شده ماکروفاژها:
در لاواژ بیماران کرونای شدید ماکروفاژهای التهابی دیده می شود. در بیماری های شدید به مقدار زیادی دیده می شود. آنالیزهای بعدی نشان داده که در واقع این ماکروفاژها منوکسیدهای التهابی هستند و ماکروفاژهای اولیه ساکن ریه کم هستند. ماکروفاژهای در بیماران شدید تایپ M1 را به خود می گیرند. این ماکروفاژها در واقع همان منوسیدهای محیطی هستند که التهابی شده اند که موکاین هایی مثل MCP1/CCL2 و MIP1A/CCL3 و ILPN/CXCL10 ترشح می کنند.
در بیماران شدید تایپ M2 ماکروفاژ هم که ژن های برای ترشح به سمت فیبروز دارند دیده می شود. در نتیجه در بیماران شدید ما یک التهاب شدید به همراه فیبروز ریوی داریم.همانطور که گفته شد در بیماران شدید افزایش ماکروفاژ M1 در ریه دیده می شود که باعث ترشح IL1B – IL6 – TNFα – MCP1/CCL2 – MIPA1/CCL3 – MIP1B/CCL4 – MCP3/CCL7 می شود. برعکس بیمارانی که بیماری متوسطی دارند مقادیر زیادی از CXCL16 که به CXCR6 وصل می شوند و روی CD8 تی سل ها هستند ترشح می شوند. هم در مورد بیماران شدید و هم متوسط CXCL9 – 10 – 11 که در واقع لیگاند CXCR3 هستند بیشتر دیده می شود. در لاواژ بیماران شدید سایتوکاین های اینترلوکین 1 بی – IL6 – IL8 - TNFα و اینترفرون گاما زیاد دیده می شود. همه این داده ها نشان می دهد که در بیماران کرونایی ماکروفاژهایی که در ریه هستند ابتدا منوسیدهای التهابی را از خون جذب می کند به سمت ریه و این منوسیدها سایتوکاین هایی را ایجاد می کنند که باعث التهاب شدید در بیماران شدید ریه می شوند.
منوسیدهای التهابی متفاوتی وجود دارد. و درصد CD14+ CD16+ که تولید کننده IL6 هستند تعدادشان با شدت بیماری ارتباط دارد. همچنین CD14+IL1β+ منوسیدهای با این خصوصیت که توسط اینترفرون فعال می شوند در بیماران کووید شدید دیده می شوند.تحریک TLR/IL-1R در واقع باعث فعالیت های التهابی منوسیدها و ماکروفاژها در بیماران کرونا هستند
نقص در نچرال کلییر سل ها:
در بیماران شدید کرونایی این سلول ها کاهش زیادی پیدا می کنند و در واقع کاهش شدید این سلول ها در بیماران کروناهای شدید دیده می شود.مشخص نیست که چرا این سلول ها کاهش پیدا می کنند آیا به خاطر این هست که این سلول ها به جایی می روند یا اینکه به خاطر مرگ سلولی کاهش پیدا می کنند. دو مطالعه متناقض نشان می دهد که احتمالا این سلول ها در طی هفته دوم وارد ریه می شود .همانطور که قبلا گفتیم ماکروفاژها لیگاندهای CXCL9 – 10 -11 ترشح می کنند که بر روی رسپتورهای CXCR3 می نشینند و قبلا نشان داده است که تحریک این زسپتور باعث افزایش ان کی سل ها در ریه می شوند.احتمال دیگر این هست که مرگ سلولی باعث کاهش این سلول ها بشود. مثلا افزایش اینترلوکین 6 با کاهش این سلول ها در خون محیطی که CD56HIGH+ هستند تناسب دارد. این احتمال وجود دارد که اینترلوکین 6 باعث کاهش گرنزیم و پرفورین شود که مکانیزم های اصلی حمله نچرال کلییر ها به ویروس ها هستند. همچنین با وجود اینترلوکین 6 شاهد کاهش اکسپروسیون CD16 روی نچرال کلییر سل ها هستیم
نقش سلول های تی :
ما در کونا شاهد لنفوپنی هستیم و کاهش لنفوسیت ها با میزان افزایش مرگ و میر همراه است.میزان سایتوکاین های داخل سرم با میزان CD4 , CD8 رابطه معکوسی دارد و وقتی که این سایتوکاین ها نرمال می شود میزان لنفوپنی ها هم کاهش پیدا می کند. در بیمارانی که فوت کردند میزان زیادی مرگ لنفوسیت ها در لنفنود ها و طحال دیده شده است. همچنین در این بافت ها ماکروفاژهای خصوصیت های فاژیک دیده می شود و نقش این ماکروفژ ها را در لنفوپنی نشان می دهد. این ماکروفاژها IL6 را اکسپرس می کنند که موجب مرگ لنفوسیتها می شود مثلا استفاده از توسیلیزومب که یک موللکولی است که روی رسپتورهای اینترلوکین 6 می نشیند و بدین ترتیب آن را مهار می کند باعث افزایش لنفوسیت ها می شود همچنین افزایش ترافیک لنفوسیت ها به داخل ریه هم نقش بزرگی در کاهش لنفوسیت ها دارد. مطالعات نشان می دهد که میزان زیادی CD4 , CD8 در بافت بینابینی ریه دیده می شود.
البته خود این لنفوسیت ها هم ممکن است در ایجاد التهاب زیاد در بیماران کرونا نقش داشته باشد در بیماران کرونا TH1 غالب است که سایتو کاین های التهابی را ترشح می کند. همچنین فلو سایتومتری نشان می دهد که میزان سلول های تی رگولاتوری کاهش پیدا کرده است.
نوتروفیل ها در بیماران شدید کرونایی افزایش نوتروفیل ها دیده می شود و در بیماران شدید شاهد افزایش NET هستیم این ها تله های اکسترا سلول ها هستند که شامل مواد DNA که خصوصیت ضد میکروب ها دارند و باعث کنترل عفونت می شوند. افزایش این NET ها با مارکر ARBS تناسب دارد این NET ها می توانند باعث صدمه به خود بافت ریوی بشوند و همچنین تولید لخته های ریز بکنند. بنابراین تولید NET ها در بیماران کرونا مختل شده است.
راه های درمان التهاب بیش از حد:
دگزامتازون 6 میلی گرم روزانه برای 10 روز اثبات کرد که باعث کاهش مرگ و میر بیماران می شود. البته دگزامتازون در این مطالعه ( RECOVERY ) نشان داد که بیمارانی که نیازی به حمایت تنفسی ندارند دگزامتازون لازم ندارند. در عین حال استفاده از دگزامتازون در بیمارانی که علایم ملایمی دارند ممکن است باعث شود که سرعت پاک شدن ویروس کمتر شود بنابرای این دارو بایستی که به مدت ده روز و در فاز دیرتر بیماری زمانی که بیمار نیاز به کمک های تنفسی دارد استفاده شود. استفاده از توسی لی زومب در مطالعات مختلفی مورد بررسی قرار گرفته است و در برخی از آن مطالعات همراه بوده است با کاهش 45 درصدی مرگ بیماران کرونایی شدید. البته این دارو می تواند موجب افزایش عفونت بشود.
داروی دیگر آناکینرا است که مهار کننده IL/1R می باشد و در نتیجه باعث کاهش IL1β می شود. مطالعات مختلفی نشان داده است که استفاده از این دارو می تواند موجب کاهش مرگ و میر بیماران شدید شود البته همانند توسیلیزومب می توانند موجب افزایش عفونت بشود. همچنین مهار کننده های تایروزین کیناز می توانند موجب کاهش IL6 – TNF α – GN/CSF – IP10 – MCP1 – MIP1α – MIP1β بشود. در نتیجه IBRUTNIB ممکن است در بیماران کوویدی موثر باشد. در نتیجه در مطالعه ای ACALABRUTINIB موجب بهبودی علائم تنفسی و اکسیژنی بیماران کوویدی شد.
هیدروکسی کلروکین موجب مهار TLR می شود و در نتیجه موجب کاهش میزان سایتوکاین ها می شود اما مطالعات مختلفی نشان داد که این دارو اثر درمانی در کرونا ندارد.