ایمنولوژی آسم:
گرچه به طور کلاسیک آسم با التهاب راه های هوایی که توسط IL4 , 5 , 13 یا در واقع سایتوکاین های ILC2 هستند شناخته می شوند و باعث می شوند میزان ائوزینوفیل ها حساسیت های ریوی و ترشح IGE بالا رود اما نیمی از بیماران آسمی در زیرمجموعه تایپ 2 ایمنی نیستند چاق هستند نوتروفیل دارند و به کورتن ها پاسخ نمی دهند.یکی از شاخص های آسم بیش فعالی راه های هوایی است که احتمالا مربوط می شود به واکنش سلول های سفید نسبت به تحرکات مثل خنده گریه یا هوای سرد. آسم معمولا در سنین جوانی رخ می دهد هر چند برخی از آسمی ها می توانند به عنوان آسم در سن بالا خود را ظاهر کنند آسمی که در دیر هنگام ظهور پیدا می کند شدیدتر است از آسم کودکان در بچه ها آتوپی پایین بودن عملکرد ریه و عفونت با رینوویروس ها فاکتورهای اصلی تشکیل دهنده آسم می باشند. از آنجایی که التهاب در آسم مرکز علت آن می باشد بنابراین درمان آسم مبتنی بر کاهش التهاب و از بین بردن آلرژن ها می باشد. آسم یک بیماری پتروژنیک می باشد. و ما اکنون دریافته ایم که همه کسانی که آسم دارند انسداد راه های هوایی برگشت پذیر ندارند و به علت تغییر ساختمانی راه های هوایی و پلاگ های موکوسی این انسداد ها می تواند دائمی باشد به هر حال تا کنون آسم به دو نوع آلرژیک و غیر آلرژیک تقسیم شده است. گرچه این تقسیم بسیار ساده انگارانه می باشد.
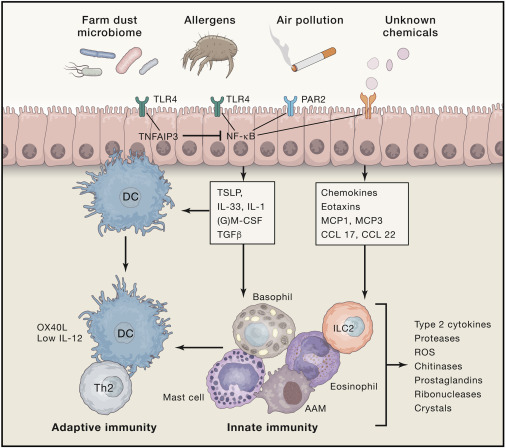
آسم کودکان معمولا همراه است با TH2 و در نتیجه همزمانی دارد با درماتیت آتوپیک و رنیت آلرژیک این نوع آسم ها در سال های اول زندگی به علت تماس با مایت های داخل گرد خانه آلودگی سوسک و بدن حیوانات ایجاد می شود و می تواند تا انتهای زندگی ادامه داشته باشد و به آسم شغلی تبدیل شود همانطور که می دانیم سایتوکاین های ایمنی نوع 2 شامل IL4 , 5 , 9 , 13 می باشند. که باعث تجمع ائوزینوفیل ها در راه های هوایی تولید بیش از حد موکوس و IGE می کنند. این آزمایش ها هم می تواند بر روی خون بیمار و هم می تواند بر روی تست پوستی بیمار ردیابی شود. سوال اینکه چرا این بیماری منحصر به راه های هوایی است و به آسم بالغین تبدیل می شود سوال نا مشخصی است. شاید این مسئله وجود داشته باشد که ایمنی بدن در اوایل کودکی در حال شکل گیری است و هر ناهنجاری در شکل گیری این ایمنی می تواند منجر به آسم شود. حتی زمانی که تحریکات به مدت طولانی برداشته شده اند. بر خلاف آسم آلرژیک آسم غیر آلرژیک معمولا در سنین بالا اتفاق می افتد بیشتر در زن های چاق اتفاق می افتد و گاها با سختی درمان مواجه است آسم بزرگسالان به دو نوع TH2 و غیر TH2 تقسیم می شود. نوع غیر TH2 معمولا همراه است با سن بالا چاقی و سیگار کشیدن. اما نوع TH2 همراه است با سینوزیت مزمن با پلیپ های بینی که به آسپرین حساسیت نشان می دهند و مقدار ائوزینوفیل های آنها زیاد می شود. در سال های اخیر فنوتایپ های آسمی به نوع 2 ایمنی و نوع بالای ایمنی به خصوص در نوع ائوزینوفیلی تقسیم شده اند. همچنین نوع آسم های غیر ایمنی 2 هم که با انتشار نوتروفیل ها همراه هستند شناخته شده اند این ها باعث شده است که راه های جدیدی در درمان آسم بر روی ما گشوده شود. گرچه نوع بالای ایمنی 2 نشان دهنده شدت بیشتر آسم است اما نوع غیر ایمنی 2 پیچیده است و تا کنون تئوری های زیادی برای آن پیدا نشده است.
پاتوفیزیولوژی آسم:
آسم با انسداد راه های هوایی مشخص می شود. تنگی راه های هوایی توسط التهاب راه های هوایی صورت می گیرد که خود به علت ارتشاح نوتروفیلی ائوزینوفیلی دندرتیک سل ها لنفوسیت ها مست سل ها و ILC ها می باشد. یکی از خصوصیت بارز آسم برگشت پذیری انسداد راه های هوایی است که می تواند با استفاده از اسپری های گشاد کننده ایجاد شود. اما در آسم های شدید این اتفاق به راحتی رخ نمی دهد شاید علت آن این باشد که پلاگ های موکوسی راه های هوایی کوچک را بسته اند. علاوه بر این تغییرات ساختمانی راه های هوایی در آسم شامل افزایش سلول های سفید متاپلازی سلول ها غددی و تجمع کلاژن های زیر پوستی راه های هوایی هم می تواند در این پدیده نقش داشته باشد.
در آسم سد اپیتلیالی به علت از دست رفتن پروتئین هایی که این سلول ها را به هم وصل می کند مختل شده و باعث شده است که افزایش نفوظ پذیری اتفاق بیفتد همچنین آلرژن هایی مثل خاک و خاشاک داخل خانه ، سوسک ها می توانند باعث شوند که آنزیم هایی فعال شوند و تماس بین سلولی اپیتلیال ضربه بخورد. ضربه به سلول های اپیتلیالی یک شاخصه ی مهم در تمام فنوتایپ های آسم می باشد و با شدت بیماری ارتباط دارد. علاوه بر این سلول های اپیتلیالی در زمان های جوانی می توانند دچار تغییر شوند و راه را برای ایجاد آسم ایجاد کنند.
رسپتورهای روی سلول های اپیتلیال که به نام TLR شناخته می شوند باعث می شوند که در تماس با تحریکات مختلف سلول های اپیتلیالی مواد شیمیایی مختلفی را تولید کنند. مثلا در موش تماس با آلرژن ها توانسته است موجب ترشح IL1α ، GMCSF ، M-CSF و TGBβ بکنند.اما در آسم شاخص ترین سایتوکاین ها مربوط می شود به IL33 , TSLP , IL25 . این سایتوکاین ها در تماس با گرد و خاک های خانگی آسپرژیلوس و موهای گربه ایجاد می شود. تمام این سایتوکاین ها در تولید TH2 و در نتیجه آسم ائوزینوفیلیک نقش دارد. IL33 و IL1RL1 رسپتور IL33 را در ST2 تحریک می کنند و شاخص آسم می باشد. IL33 در لاواژ بیماران آسمی شدید با شدت بیماری ارتباط دارد بیمارانی که آسم ائوزینوفیلیک دارند مقدار سرم IL33 آنها بالاتر است و سرم ائوزینوفیل خلط آنها بالاتر است.
IL25 در بیماران نوع دومی آسمی بالا می رود و باعث می شود که تحریک پذیری زیاد از حد راه های هوایی ایجاد گردد. همچنین میزان ائوزینوفیل های خون و راه های هوایی و میزان IGE خون هم بالا رفت این نوع از آسم ضخامت زیر اپیتلیالی دارند و ژن TH2 زیادی را اکسپرس می کنند.
TSLP در راه های هوایی بیماران آسمی زیاد می شود و با شدت بیماری ارتباط دارد. TSLP می تواند به طولانی شدن ILC2 کمک بکند و باعث بشود که بیمار به کورتن جواب ندهد البته PSLP در فنوتایپ نوتروفیلی هم نقش دارد.
شروع پاسخ ایمنی 2 مربوط می شود به فعالیت دندرتیک ها بسیاری از سایتئکاین های ذکر شده مثل IL33, TSLP,IL1α,GMCSF, می توانند به واسطه رسپتورهای مختلف ایمنی نوع 2 را تحریک کنند.از سوی دیگر نوع دیگری از دندرتیک ها قادر به تحریک ایمنی نوع 2 نیستند و این نشان می دهد که نقش دندرتیک ها حفاظت از آسمی ها از میان تولید TH1 توسط IL12 که TH2 را مهار می کند باشد. دندرتیک ها نه تنها در حساسیت به آلرژن ها در آسم های مزمن نقش بازی می کنند تعداد آنها هم در راه های هوایی آسمی زیاد می شود. دندرتیک ها رسپتورهای TSLP را اکسپرس می کنند و کموکاین های همراه با تایپ 2 آسمی را در آسم های شدید ایجاد می کند.اما پای این سلول ها نیاز به تایپ 1 اینترفرون برای حفظ ایمنی نوع دوم داشته باشند هنوز مورد بحث است. در موش هایی که رسپتورهای دندرتیک آنها کاهش پیدا کرده است میزان تحریک آسم آنها به آلرژن ها کاهش پیدا کرده است. بنابراین سوال بزرگ این است که نقش دندرتیک ها در آسم طولانی چه می باشد. در مطالعات اخیر گروه ما نشان داده است که دندرتیک های با منشا منوسیت ها بعد از تماس با آلرژن ها افزایش پیدا می کنند و موجب افزایش TH2 و ائوزینوفیل می شوند.
ایمنی انطباقی نوع 2 در آسم:
برخی از انواع آسمی ها با تایپ 2 ایمنی بسیار بالا همراه هستند اینها افزایش IL4 , 13 , 5 را نشان می دهند. که تحت تاثیر دندرتیک ها در سلول های اپیتلیال می باشند
میزان IL4 , 5 , 13 , 9 در بیماران آسمی آلرژیک زیاد می شود در موش هایی که CD4 آنها از بین رفته است میزان توسعه آسم جلوگیری شده است . TH2 به نظر می رسد که نقش بسیار مهمی در سایتوکاین های TH2 دارد که با اکسپرسیون رسپتورهای اینترلوکین 33 این نقش ها ایفا می کند مطالعات نشان داده است که فعالیت IL4 همراه بوده است با افزایش IGE توسط سلول های بی که باعث افزایش تحریک پذیری راه های هوایی می شود و اکسپرسیون مولکول های چسبنده را تحریک می کند و باعث افزایش نفوذپذیری می شود. بسیاری از این اعمال توسط IL13 با استفاده از تحریک رسپتور IL4 صورت می گیرد.
اخیرا IL13 در تولید TCELL های FH نقش خود را ظاهر نموده است مطالعات در موش ها نشان می دهد که افزایش ارتشاح IL5 موجب افزایش فعالیت ائوزینوفیل ها می شود اما نقش اینها در افزایش تحریک پذیری راه های هوایی نا معلوم است.
نقش IL9:
IL9 توسط سلول های مختلفی در زیر مجموعه TH2 ترشح می یابد و نقش مهمی در آسم های آلرژیک دارند همچنین نقش این مولکول روی ائوزینوفیل ها و نوتروفیل ها اثبات شده است. لاواژ بیماران آسمی افزایش اکسپرسیون IL9 را نشان می دهد همچنین در آسم ائوزینوفیلیک. اما تا کنون نقش IL9 در آسم نوع 2 نامشخص مانده است. در موش هایی که آنتی بادی های ضد IL9 دریافت کرده اند خصوصیت آسمی کمتری شامل تحریک پذیری راه های هوایی نشان داده اند. برعکس تجویز TH9 باعث شده است که هم تحریک پذیری راه های هوایی هم ائوزینوفیل ها و هم تولید موکوس ها مشابه با فنوتایپ TH2 افزایش پیدا کند.
نقش سلول های دندرتیک در آسم:
در انسان ها و موش ها لنفسیت های حافظه ای شامل لنفوسیت های حافظه ای مرکزی و حافظه ای موثر می باشند که در خون وجود دارند. لنفوسیت های حافظه ای غیر جاری در بافت ها قرار دارند. بسیاری از CD4 های حافظه ای تی (TRM) در موضوع آسم های ائوزینوفیلیک مورد بررسی قرار گرفتند. این سلول ها با وجود از بین رفتن آلرژن ها برای مدت طولانی متاسفانه در ریه موش های آسمی حضور دارند و باعث تحریک نوع 2 آسم می شوند TRM ها نسبت به سلول های در جریان خونی سایتوکاین های TH2 بیشتری ترشح می کنند. و می توانند به سرعت و در تماس با آلرژن ها فعال شوند. یک تز این هست که سلول های دندرتیک با واسطه ی CD11B+ در تماس با آنتی ژن فعال می شوند و آنتی ژن را بدون اینکه به غدد لنفاوی بروند اکسپرس می کنند.
فهم ما از این سوال که آیا TH2 و CD4TRM با هم عمل می کنند و باعث به وجود آوردن آسم می شوند ناقص است. مثلا در موش ها که تعداد سلول های حافظه ای در خون کاهش پیدا کرده است ولی CD4TRM ها در ریه باقی مانده اند توانسته اند به اندازه کافی آسم شدید به وجود بیاورند. TH2 حافظه ای در جریان خون عمدتا در پارنشیم قرار دارند که مسئول ارتشاح ائوزینوفیل ها و تی سل ها هستند TRM ها نزدیک اپیتلیوم قرار دارند و باعث ترشح موکوس فعالیت ائوزینوفیل و تحریک پذیری راه های هوایی می شوند. این اطلاعات با وجود رسپتور IL33 به نام ST2 که در روی سلول های TRM هستند مطابقت دارد. نشان می دهد که TRM ها به طور مستقیم به وسیله IL33 تولید شده توسط سلول های اپیتلیال فعال می شود. به علاوه TH2 حافظه ای ST2 در ساختمان های لنفوئیدی می مانند و تحت تاثیر IL33 ترشح شده توسط سلول های اپیتلیال و فیبروبلاست ها قرار می گیرند. بحث TRM ها نیاز به بررسی بیشتری دارد.
نقش بی سل ها و IGE در آسم:
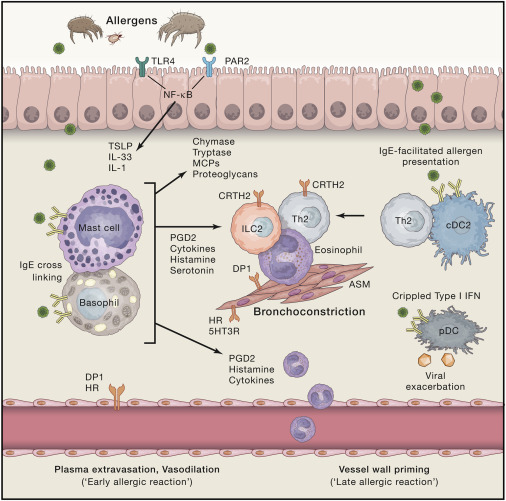
بعد از این که TH2 در لنفنودهای ریوی شکل گرفتند قسمتی از آنها با سلول های بی واکنش نشان می دهند و آنها را تبدیل به پلاسما سل ها می کنند. تحت تاثیر IL4 و IL13 این سلول های بی تولید IGE می کنند. اگرچه تولید IGE در ارگان های لنفوئیدی ثانوی عمدتا تولید می شوند اما شواهدی وجود دارد که IGEها در موکوس بیماران ریوی هم تولید می شوند. IGE ها به رسپتورهای CD23 وصل می شوند که روی بازوفیل ها مست سل ها و ائوزینوفیل ها و دندرتیک سل ها قرار دارند این رسپتورها همچنین روی سلول های عضلانی سفید و آندوتلیال ها و اپیتلیال ها هم قرار دارند IGE ها در بیماران آسمی توسط سلول های بی حافظه ای ترشح می شوند.
تاثیر IGE ها روی ماست سل ها و بازوفیل ها:
IGE ها توسط رسپتور FceRI روی مست سل ها و بازوفیل ها موجب ایجاد آبشارهای آلرژیک می شوند. IGEها آنتی ژن های روی ماست سل ها و بازوفیل ها را فعال می کنند و باعث ترشح هیستامین پروتئاز کیماز و تریپتاز می شوند. این ها به نوبه ی خود تولید مواد دیگری می کنند از جمله کموکاین های TH2 شامل IL4 , 5 13 , 9 و باعث می شوند که فضای التهابی ایجاد شود. تماس IGE ها با مست سل ها باعث می شود که واکنش حمله ای سریعی در آسم اتفاق بیفتد که همراه است با افزایش نفوذپذیری عروق و ارتشاح سلول های التهابی در ریه. علاوه بر آن ماست سل ها زیر غدد موکوسی قرار دارند و می توانند IL4, 13 , PGD2 , LTC4 را از طریق تحریک سلول های غددی ترشح بکنند. در نهایت ماست سل های که روی سلول های سفید قرار دارند می توانند باعث افزایش آنها و بزرگ شدن آنها شده و موجب ایجاد تحریک پذیری راه های هوایی کنند.
برای سالها وجود IGE با حمله شدید آسمی ترجمه می شد. دو رسپتور بر روی سلول های عضلانی سفید قرار دارند که توسط IGE تحریک می شوند. این ها باعث می شوند که سایتوکاین ها جهت ایجاد راه های تحریک پذیر هموار شود. علاوه بر آن IGE ها با واسطه تداخلشان با دندرتیک سل ها می توانند باعث شوند که آنتی ژن ها به لنفوسیت های T2 حافظه ای معرفی شوند. در واقع این فرایند باعث می شود که واکنش سلول های TH2 سریعتر صورت بگیرد.
کار دیگر IGEها تماس و تحریک دندرتیک های پلاسما سیتوئید می باشداین سلول ها به خصوص در تولید اینترفرون نوع 1 مهارت دارند که خصوصیت ضد ویروسی دارد. در نتیجه با ورود ویروس به ریه ما شاهد افزایش اینترفرون نوع 1 و التهاب خواهیم بود.
نقش ائوزینوفیل ها در آسم:
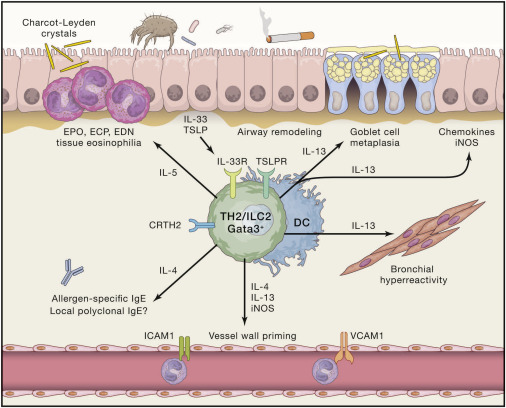
ائوزینوفیل ها در مغز استخوان تشکیل پیدا می کند. و آنجا بالغ می شوند و قابلیت تماس با IL5R را پیدا می کنند. قبل از اینکه وارد جریان خون شوند. بعد از ورود به جریان خون ائوزینوفیل ها یا در داخل بافت های محیطی می مانند و یا در داخل مغز استخوان. IL5 یک سایتوکاین اصلی است که در توسعه این سلول ها در مغز استخوان نقش دارد. IL5 باعث می شود که این سلول ها از مغز استخوان به بافت های آلرژیک وارد شوند. در انسان 2 نوع ائوزینوفیل وجود دارد. نوع کم فشرده آن فعالیت بیشتری دارد و در لاواژ سلول های آسماتیکی زیاد دیده می شود. به علاوه ائوزینوفیل های کم فشردگی به درمان های کورتنی جواب بیشتری می دهند. نقش ائوزینوفیل ها در تولید آسم مورد بررسی زیادی قرار گرفته است. IL5 که توسط TH2 تولید می شود باعث می شود که ائوزینوفیل ها از خون وارد ریه شوند. این ائوزینوفیل ها سایتوکاین های التهابی از جمله ECP و MBP و IL4,5,9,13,25 را به همراه TNFα و IL1β, IL6 , IL8 تولید می کند. تمام این مواد شیمیایی باعث می شود که شدت آسم افزایش پیدا کند تحریک پذیری راه های هوایی زیاد شود و سلول های غددی بزرگ شوند. به علاوه ارتشاح ائوزینوفیل ها باعث می شود که با واسطه پروتئین های ترشح شده بافت ریوی صدمه بخورد علاوه بر آن ائوزینوفیل ها در تولید مواد فیبروزی مانند TGFβ نقش دارند. که خود باعث تغییرات ساختمانی با ضخامت سلول های عضلانی و سلول های غددی و افزایش ECMP می شوند علاوه بر آن ائوزینوفیل ها نقش مهمی در ایجاد افزایش تحریک پذیری راه های هوایی دارند. ائوزینوفیل ها می توانند با تولید تله های خارج سلولی که در واقع فیبرهای DNA هستند نقش دیگری بازی کنند. این تله ها بر ضد پاتوژن های خارج سلولی نقش دارند. در واقع این تله ها در آسم شدید زیاد دیده می شوند و می توانند باعث شود که سلول های اپیتلیالی تولید IL33 و TSLPبکند. همچنین وابستگی بین این تله ها و کریستال های شارکولیدن دیده شده است . یکی از پروتئین های توسط ائوزینوفیل ها ترشح می شود ژالکتین 10 نامیده می شود. این مواد در آسم ها به میزان زیادی دیده می شود و باعث تولید موکوس پلاک ها می شود. تصور می شود که این مواد به همراه تله های ذکر شده باعث تغییراتی در موکوس می شوند که آنها را برای بیرون دادن از ریه سخت تر می کنند. تولید IGE و موکوس به همراه ایستایی TH2 به وسیله ی آنتی بادی های ضد این مواد تسریع می شود. این کریستال ها به نوبه ی خود باعث از بین رفتن نوتروفیل ها می شود.که خود می تواند موجب پایداری نوع دوم ایمنی بگردد.
ILC2:
ICLها در بافت های موکوسی قرار دارند و نقش مهمی در هموستاز برقرار می کنند. بر خلاف آن ICLهای التهابی در مقابل میکروب ها انگل ها و آلرژن ها سایتوکاین های متعددی در ظرف ساعت ها تولید می کنند. ICLها فنوتایپ های مشابهی با لنفوسیت ها دارند و به سه تایپ تقسیم می شوند. ICLها عملکردهای وابسته به بافتی از خود نشان می دهند. ICL2 همانند TH2 عمل می کند و فنوتایپ آن را دنبال می کند و موجب تولید IL5,9,13 می شود. ICLها اساسا به سایتوکاین های ترشح شده توسط اپیتلیوم همانند IL33 و IL25 و TSLP واکنش نشان می دهند.
نقش ICL2در آسم:
در انسان نقش ICL2 در آسم برجسته است. میزان ICL2 در خون و لاواژ بیماران آسمی زیاد است. مطالعاتی نشان داده که رشد همزمان ILCL2 با IL13 ناشی از ICL2 می تواند موجب اختلال در ساختمان اپیتلیال بشود. تحت تاثیر IL33 و ILC2 تولید IL5 و IL13 می کند که باعث می شود ارتشاح ائوزینوفیلی و تحریک پذیری راه های هوایی به وجود بیاید. ILCL2 باعث می شود دندرتیک ها به غدد لنفاوی مهاجرت کنند که خود تحت تاثیر IL13 می باشد. این باعث می شوند که TH2فعال شود. علاوه بر این با ورود پارازیت ها ILC2 می تواند نقش معرفی آنتی ژن ها را بازی کند.
آسم های نوع 2:
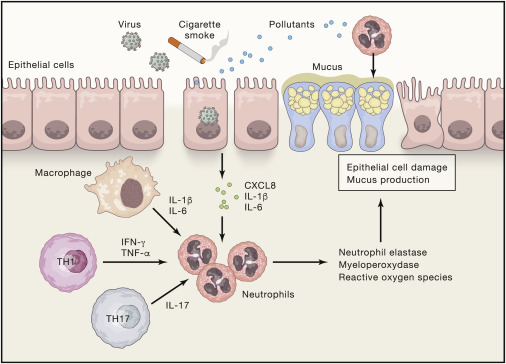
آسم های نوع 2 به آسم هایی گفته می شود که TH2 در آن نقش نداشته باشد این آسم ها بیشتر در افراد مسن دیده می شود و نیاز به کورتن بیشتری جهت کنترل بیماری دارد و همچنین این آسم ها همراه است با چاقی. همه این آسم ها بیماران داروهای زیادی مصرف کرده اند که باعث شده است چاقی آنها بدتر شود. این ها بیشتر خانم ها هستند مطالعات زیادی در نقش IL6 در این آسم ها انجام شده است. یکی از این مطالعات به نقش IL-1β برمی گردد. در یک مطالعه با این نوع آسم ها نشان داده شد که این آسم ها DNA خارج سلولی زیادی دارند که می تواند نقش NET را به یاد بیاورد. این گروه از آسم ها همچنین نوتروفیل زیادی در خلط دارند و مقدار زیادی IL1β. اما مطالعه ای که بر روی مهار کننده ی CXCR2 که اتصال CXCL8 را مهار می کند و باعث کاهش ارتشاح نوتروفیلی می شود با شکست روبه رو شد. در نتیجه تئوری این نوع آسم ها از نوع نوتروفیلیک به نظر ساده می نماید. مطالعات جدیدی در روی بچه ها و بالغین با آسم های نوتروفیلیک نشان داده است که آنها مواد داخل نوتروفیل ها مثل میلوپراکسیتاز و الاستاز را زیاد در بافت تخریب شده ریه به میزان زیادی دارند. علاوه بر این ریختن نوتروفیل ها به لاواژ بچه هایی که نوتروفیل های زیادی داشتند موجب افزایش فاگوسیتی و NET شده است که هر کدام می توانند بر روی سلول های اپیتلیال ضربه وارد کنند. ینها نشان می دهد که نوتروفیل ها در واقع سلول های افکتور در تایپ 2 آسمی هستند که در ریه آنها عملکرد های پاتوژنیک ایجاد کردند.
در بیماران متوسط تا شدید آسمی میزان IL17A و IL17F و IL22 افزایش پیدا کرده است. این ها می توانند موجب ارتشاح نوتروفیل ها بشوند اما گیج کننده تر این است که IL17 گاها جلوی شدت آسم را می گیرد و آن وابسته است به مهار IL17 در زمان مناسب. در مطالعه ای نشان داده شد که IL17 فقط در طی فاز حاد موثر است. گرچه مهار IL17 روزنه بخش است اما این فقط در حیوانات نشان داده شده است. برای این منظور محققان LPS زیادی به بیماران دادند که می تواند موجب تقویت TH17 شود در واقع محققان تلاش کردند یک فنوتایپ آسمی نوتروفیلیک با سایتوکاین های TH2 پایین اینترفرون گاما بالا و IL17 بالا تولید کنند. در این مطالعات نشان داده شد که اینترفرون گاما موجب تحریک پذیری راه های هوایی شده است نه IL17. برای اینکه موضوع پیچیده تر شود مطالهات اخیر نشان داده است که نوتروفیل ها در آسم نوع 2 نقش دارند و در واقع NETها که توسط رینووایروس ها تولید شده اند در حملات آسمی دیده شده اند. بنابراین ارتباط T17 و تایپ نوتروفیلیک آسمی پیچیده است. در حال حاضر مطالعه ای در مهار اینترلوکین 13 و 17 در روی موش ها در حال انجام است.
نقش ویروس ها در آسم:
آسم توسط عوامل مختلف می تواند تحریک شود از جمله سیگار کشیدن آلودگی هوای سرد آلرژن ها و میکروب ها از میان این ویروس ها ویروس های تنفسی به خصوص RSB و RV مهم ترین هستند.
نقش اینترفرون 1 :
هنگانی که ویروس ریه را درگیر می کند و موجب حملات آسمی می شود مکانیزم هایی در این حملات وجود دارد. سلول های مبتلا به ویروس تولید نوع 1 و نوع 3 اینترفرون می کنند به طور جالبی حملات عمدتا در بیماران چاق و با ائوزینوفیل بالا که تایپ 2 آسمی دارند و میزان کاهش اینترفرون 1 دارند به خصوص اینترفرون بتا و اینترفرون نوع 3 ایجاد می شود. در مطالعه اخیر نشان داده شد که اکسپرسیون TH2 و کم اکسپرسیون تایپ 1 اینترفرون همراه است با حملات کوتاه. تصور می شود که سطح IGE E موجب می شود که بیمار به عفونت بیشتر مبتلا شود. در مطالعه ای نشان داده شد که ترکیب IGE به دندرتیک های پلاسما سایتوئیدها توانایی تولید تایپ 1 اینترفرون را مهار کرد و از این رو باعث شد ویروس گسترش بیشتری پیدا کند و التهاب بیشتری ایجاد کند و حملات آسمی بیشتری پیدا شود.علاوه بر آن ویروس مشابهی مثل RSV در موش ها توانست که تولید نوع 1 اینترفرون را مهار کرده و باعث برونشیولیت ویروسی و آسمی شود.
به خاطر اینکه حملات آسم بیشتر در بیمارانی است که ائوزینوفیل بالایی دارند به همراه IGEبالا پیشنهاد می شود که تایپ 2 آسمی از دیدگاه متفاوت تری از TH2 مورد بررسی قرار گیرد مطالعات جدید نشان داده است که در طول آسم ویروسی IL33 به میزان زیادی توسط سلول های اپیتلیال ترشح می شود و موجب می شود پاسخ اینترفرون 1 بر ضد ویروس کاهش پیدا کند. مطالعات بیشتر در مورد ویروس راینو وایروس نشان داد که IL33 موجب می شود که اپیتلیوم بیشتر مورد تهاجم ویروسی قرار گیرند.
نقش ایمنی ذاتی نوع 2:
از آنجایی که ورود ویروس موجب افزایش IL33 و TSLP می شود توسط سلول های اپیتلیال بنابراین نباید موجب تعجب باشد که کودکانی که مورد حمله ویروس ها قرار می گیرند میزان زیادتری از ILC2 دارند اما در مورد آنفولانزا و ملات آسمی آن ILC2 که ناشی از TH2 می باشد ابتدا کاهش پیدا می کند ولی در زمانی که ویروس در حال پاک شدن است افزایش پیدا می کند اگر چه آنفولانزا ویروس شایعی در حملات آسمی نیست یک تقسیم کاری بین TH2 و افزایش فعالیت ILC2 در پایان بیماری موجب بهبود بیماری می شود. در طوا عفونت ویروسی ما شاهد افزایش تایپ 1 اینترفرون و تایپ 2 اینترفرون هستیم که خود باعث مهار ILC2 می شود. در نهایت موجب اختلال پاسخ ضد ایمنی در طی عفونت ویروسی تایپ 1 اینترفرون افزایش پیدا می کند موجب افزایش سلول های دندرتیک می شود که به نوبه ی خود موجب افزایش فعالیت CD4 , CD8 می شود. ارتباط بین اینترفرون نوع 1 و سلول های دندرتیک و حملات آسمی ناشی از ویروس بسیار پیچیده است. وقتی که ویروس های کم توان تری ریه را درگیر می کنند میزان افزایش IL33 باعث می شود که فعالیت بیشتری در TH2 و ILC2 پیدا شود که هر دو باعث می شوند علائم آسم شامل تحریک پذیری راه های هوایی و ائوزینوفیل ها تشدید شود. برای اینکه مسئله پیچیده تر شود باید در نظر داشت که خود ائوزینوفیل نقش ضد ویروسی دارد در واقع مواد داخل ائوزینوفیل می توانند موجب شوند که RSV از بین برود علاوه بر آن اکسپرسیون بیش از حد اتوتاکسین 2 و IL5 برعلیه عفونت های ویروسی ریوی موثرند. از طرفی دیگر کاهش ائوزینوفیل ها توسط آنتی بادی های ضد IL5 باعث می شود میزان ویروس ها در ریه های موش ها افزایش یابد. به علاوه موش هایی که ائوزینوفیل های طبیعی دارند در مقابل ویروس های ریوی مقاوم ترند. بنابراین نا توانی ائوزینوفیل ها در مقابل ویروس های ریوی و تا سطح کمتری تایپ 1 اینترفرون می تواند توسط پاسخ ضد ویروسی دندرتیک ها توجیه شود.
داروهای بیولوژیک آسم:
تا کنون اثبات شده است که ائوزینوفیل ها نقش عمده ای در نوع 2 آسم دارند. التهاب ائوزینوفیل ها در راه های هوایی با شدت آسم هماهنگی دارد و یک نسبت بین بافت و خون ائوزینوفیل ها در حملات آسمی وجود دارد. ائوزینوفیل ها توسط IL5 ترشح می شوند که خود توسط TH2 ماست سل ها و ILCها ترشح می شوند بنابراین به نظر می رسد که مهار IL5 می تواند کاندید خوبی برای مهار آسم در نظر گرفته شود. اولین نوع این آنتی بادی ها مپرولیزومب می بود که بر علیه IL5 فعال بود و از جنس IGG1 ساخته شده بود این دارو نشان داد که هم باعث بهبود عملکرد ریه شده و هم باعث کاهش استفاده از کورتن ها موفقیت این دارو با رزلیزومب که یک IGG4 برعلیه IL5 هست نتایج مشابهی را نشان داد. داروی دیگر بنرالیزومب بود که در اشکال شدید آسم باعث کاهش حملات آسم و نیاز به استفاده از کورتن های خوراکی شد دسته دوم داروها متعلق به داروهای ضد IL4 می باشد. IL4RA به IL4 و IL13 وصل می شود. این دارو یک سایتوکاینی است که باعث مهار تولید IGE توسط سلول های بی سل تحریک پذیری راه های هوایی متاپلازی غدد اپیتلیال تولید موکوس و افزایش ضخامت قشا اپیتلیال و فیبروز می شود. از میان این داروها دوپیلومب یک آنتی بادی است که IL4Rα را مهار می کند. این دارو موجب بهبود عملکرد ریه در حملات آسمی شد حتی این دارو در آسم های غیر ائوزینوفیلی موثر بود. هم اثر بیشتری نسبت به آسم ائوزینوفیلی داشت هم باعث کاهش حملات آسمی شد و هم باعث بهبود عملکرد ریوی اما در 15 درصد از بیماران ما شاهد افزایش ائوزینوفیل ها بودیم که احتمالا ناشی از رهاسازی آنها از خون بوده است. در حال حاضر دوپیلومب کاندید خوبی برای آسمی هایی هست که با بیماری های آلرژیک همراه هستند. داروی بعدی یک مطالعه بر روی آنتی بادی ضد IL9 در بیماران متوسط تا شدید آسمی نتایج امیدوار کننده ای به همراه نداشت. دلایل مختلفی برای این موضوع آورده شد. داروی بعدی مهار کننده IGE است اگر چه عملکرد IGE منطبق هست با سایتوکاین های TH2 بی مورد نبود که اومالیزومب موفقیت خوبی را در کاهش استفاده از استروئیدها کاهش حملات آسمی و بهبود عملکرد ریوی نشان بدهد. جالب توجه این است که میزان IGE در بیماران شاخص خوبی برای جواب به این دارو نیست. در یک مطالعه نشان داده شد که بیمارانی که ائوزینوفیل بالایی داشتند بهترین نفع را از این دارو گرفتند و حتی کودکان با آسم غیر آلرژیک ائوزینوفیلیک هم از این دارو بهره بردند. بنا براین مهار IGE یک داروی سالم و موثر در تایپ 2 بالای آسمی است نه در تایپ پایین 2. تقریبا 70 درصد از بیمارانی که این دارو را گرفتند پاسخ مناسبی از این دارو کسب کردند داروهای جدیدتر شامل داروهایی هستند که سایتوکاینهای تولیدی توسط اپیتلیال را از جمله IL1 و IL33 و IL25 و TSLP را مهار می کنند. از میان این داروها داروهایی که TSLP و IL33 را مورد هدف قرار داده اند مورد بررسی قرار گرفته اند اما نتایج این مطالعات هنوز انتشار نیافه است. اگر چخ استفاده از داروهای بیولوژِک ضد تایپ 2 زندگی بیماران شدید آسمی را متفاوت کرده است اما همه این بیماران به خوبی به این داروها پاسخ نداده اند. این نشان می دهد که اگر چه میزان ائوزینوفیل ها گاها می تواند برای هدایت درمان استفاده شود اما مطالعات بیشتری در زمینه سایر معیار ها باید انجام بگیرد. مثلا بایومارکری همچون FeNO یا پریوستین می تواند همراه ائوزینوفیل میزان جواب به داروها را برای ما تعیین کند مسئله دیگر این است که اگرچه آُم ائوزینوفیلی ممکن است سال ها به طول بیانجامد و به علت پلاک های موکوسی سرفه های سختی ایجاد بکند. برخی از بیماران نشان داده اند که علت این موضوع پلاک های موکوسی است که از کریستال های شارکولیدن تولید شده توسط ائوزینوفیل ها ایجاد می شود این باعث می شود که این بیماران انسداد غیر قابل برگشتی را از خود نشان دهند. باید تحقیقات بیشتری انجام بگیرد تا بفهمیم که داروهایی که ائوزینوفیل ها را تحت تاثیر قرار می دهد آیا می تواند روی این پدیده اثر بگذارد یا نه.
در نهایت همه بیماران آسمی تایپ 2 به داروهای ضد تایپ 2 جواب نمی دهند و ممکن است وارد فاز مقاوم بیماری بشوند. در واقع NOS که نه تنها یک سایتوکاین TH2می باشد بلکه به وسیله اینترفرون گامای TH1 هم تولید می شود ممکن است این نظریه را تقویت کند که افزایش FENOتنها مارکر نشان دهنده التهاب تایپ 2 نیست. به علاوه مطالعه دیگری هم نشان داد که بین TH17 و تایپ 2 آسمی ارتباطاتی وجود دارد.
دیدگاهها
خوراکخوان (آراساس) دیدگاههای این محتوا